


Hodžkina limfoma ir salīdzinoši reti sastopams vēzis, kas veidojas limfātiskajā sistēmā. Limfātiskā sistēma ir daļa no imūnsistēmas, kas organismā cīnās pret infekcijām un slimībām, tostarp no vēža.

Limfātiskā sistēma pārnēsā imūnsistēmas šūnas pa visu organismu un sastāv no:

Normāli veselam cilvēkam limfmezgli ir tik mazi, ka tos nevar sataustīt un tos ikdienā nejūtam. Bet dažādu slimību gadījumos tie var palielināties un kļūt sataustāmi, piemēram, uz kakla vai padusēs. Ir arī tādi limfmezgli, ko sataustīt nevar, piemēram, starp plaušām. Tādēļ dažreiz tos iedala arī taustei pieejamos un taustei nepieejamos limfmezglos. Otrie ir jāizmeklē ar speciālu aparatūru – ultrasonogrāfu vai datortomogrāfu.
Limfoma ir limfātiskās sistēmas vēzis jeb ļaundabīgs audzējs. Parasti veselā organismā ir kontroles mehānismi, kas nosaka šūnu augšanu un bojāeju, kā arī aizsargmehānismi, kas iznīcina potenciālo vēža šūnu, ja tāda organismā rodas. Limfomas gadījumā limfocīti sāk nekontrolēti augt un veido lielus šūnu sakopojumus, visbiežāk limfmezglos, kas šādā gadījumā palielinās.
Izmainītie limfocīti izplatās tālāk organismā un sāk augt arī kaula smadzenēs, liesā, plaušās, aknās, parādās asinīs. Limfomas šūnas var būt ļoti dažādas, tādēļ pēc tā, kādas šūnas atrod mikroskopā, izmeklējot limfmezgla paraugu, limfomas iedala divās lielās grupās – Hodžkina slimība jeb Hodžkina limfoma un nehodžkina limfomas.
Hodžkina slimība savu nosaukumu ieguvusi pēc tam, kad to pirmo reizi aprakstīja britu ārsts Tomass Hodžkins. Tā sastopama daudz retāk nekā nehodžkina limfoma, no kuras tā atšķiras ar specifisku liela izmēra šūnu (Rīda-Sternberga šūnu) klātbūtni (to nosala ar mikroskopiskas audu analīzes palīdzību). Hodžkina limfoma labi padodas ārstēšanai. Hodžkina limfomai ir divi paveidi:
Visbiežāk Hodžkina limfomu diagnosticē vai nu cilvēkiem vecumā no 15 līdz 30 gadiem, vai pēc 55 gadu vecuma.

Tipiskākā Hodžkina limfomas pazīme ir viens vai vairāki palielināti, nesāpīgi limfmezgli, visbiežāk kakla, padušu un cirkšņu rajonā.

Tā kā limfmezgli ir organisma imūnsistēmas daļa, tie bieži palielinās dažādu infekciju un iekaisumu gadījumā. Tādos gadījumos limfmezgli ir sāpīgi, cilvēkam ir arī paaugstināta ķermeņa temperatūra un citas infekcijas pazīmes. Ļaundabīgo procesu izmainītie uzkrājas limfocīti limfmezglā, tādēļ tas palielinās. Taču limfomas gadījumā palielinātie limfmezgli ir nesāpīgi, un tā var būt pirmā limfomas pazīme.
Bieži vien pats slimnieks nejauši satausta vai ierauga spogulī, piemēram, palielinātus kakla limfmezglus. Slimības sākumā limfmezgli ir palielināti tikai vienā ķermeņa pusē, respektīvi, asimetriski. Tā ir svarīga pazīme, jo ir arī citas hematoloģiskas slimības, kur limfmezglu palielinājums ir simetrisks, piemēram, abās kakla pusēs. Limfmezglu izmēram pieaugot, tie var spiest uz apkārtējiem audiem, radīt tūsku.
Tā kā palielinātie limfmezgli visbiežāk ir nesāpīgi, tas var radīt mānīgu iespaidu, ka stāvoklis nav nopietns. Tomēr ir otrādi – sāpoši limfmezgli visbiežāk ir infekcijas pazīme, bet nesāpīgi – var liecināt par audzēju, it īpaši, ja tie kļūst ļoti cieti. Daudziem pacientiem slimības diagnosticēšanas brīdī nav nekādu citu simptomu, izņemot palielinātus limfmezglus. Tādēļ ļoti svarīgi pie ārsta doties arī tad, ja palielinātie limfmezgli nesāp. Ir vēl trīs tipiski limfomai raksturīgi simptomi, ko sauc par “B” simptomiem:
Bez B simptomiem Hodžkina limfoma var izpausties arī ar ādas niezi, izteiktu nespēku un vispārēju nogurumu un saasinātu ķermeņa reakciju uz alkoholu, arī limfmezglu niezi pēc alkohola lietošanas (šī parādība sastopama reti).
Ja Hodžkina limfoma skārusi krūškurvja limfmezglus, plaušas vai pleiru jeb plaušu plēvi, var parādīties hronisks klepus vai elpas trūkums. Gadījumos, kad skarti vēdera limfmezgli vai vēdera orgāni, slimība var izraisīt sāpes vēderā, muguras sāpes vai caureju. Savukārt, ja limfoma skārusi kaulus un kaulu smadzenes, novēro kaulu un locītavu sāpes, var parādīties arī izteikts bālums sarkano asins ķermenīšu trūkuma dēļ.

Precīzi Hodžkina limfomas cēloņi nav noskaidroti, ir zināms vien tas, ka slimība sākas līdz ar izmaiņām limfocītu DNS struktūrā.

Taču ir zināmi vairāki riska faktori, kas palielina varbūtību saslimt ar nehodžkina limfomu:

Jo agrīnāk tiek noteikta diagnoze, jo labāk. Tad parasti terapija ir saudzīgāka, savukārt prognoze un iespēja izārstēties – labāka. Ja diagnoze noteikta agrīni, limfoma vairumā gadījumu nav ietekmējusi ne nieru, ne aknu darbību, ne sirdsdarbību, tādēļ arī nav nekādu ierobežojumu ārstēšanas veida izvēlē.

Hodžkina limfomas diagnosticēšana parasti sākas, ārstam apskatot un izmeklējot pacientu. Šādas klīniskās izmeklēšanas laikā tiek noskaidrota detalizēta pacienta līdzšinējo saslimšanu vēsture un veikta pacienta apskate, novērtēts limfmezglu stāvoklis kaklā, padusēs, cirkšņos.
Hodžkina limfomas diagnosticēšanai piemēroti šādi attēldiagnostikas izmeklējumi:
Lai precizētu Hodžkina limfomas izplatību, veic arī asins analīzes: pilnu asins ainu, eritrocītu grimšanas ātrumu, aknu funkcionālos testus (tostarp ALAT un ASAT), laktātdehidrogenāzes līmeni; var būt nepieciešami arī HIV un B un C hepatīta testi.
Limfomas galīgo diagnozi nosaka ar biopsijas palīdzību – ar mikroskopu izmeklējot limfmezgla vai kādu citu audu paraugu. Visbiežāk veic limfmezglu biopsiju un kaulu smadzeņu biopsiju:
Audu paraugam tiek veikta mikroskopiska imunohistoloģiskā analīze, lai noteiktu, kādi proteīni ir klātesoši uz šūnu virsmas – šī informācija palīdz uzstādīt precīzu diagnozi. Biopsijas materiālu laboratorijā apstrādā ar speciālām vielām, kuras piesaistās noteiktiem šūnu virsmas receptoriem (olbaltumvielām) un šīs šūnas iekrāso. Tas ļauj ārstam patologam izdarīt slēdzienu par slimību.
Hodžkina limfomas terapijas plānošanai var būt nepieciešami arī plaušu izmeklējumi:

Hodžkina limfomas stadijas pieaugušajiem nosaka, izmantojot t.s. Lugano klasifikācijas sistēmu, 1971. gadā Ennārborā (Ann Arbor, ASV) izstrādātās klasifikācijas versiju. Slimībai ir četras stadijas, kuras apzīmē ar romiešu cipariem no I līdz IV.

I–II stadijas limfomai gadījumos, kad tā skar ārpus limfātiskās sistēmas esošu orgānu, stadijas apzīmējumam pievieno burtu E (IE vai IIE). Stadijas apzīmējumam var pievienot arī burtu A vai B: ja pacientam novēro B simptomus (svīšana, drudzis, svara zudums), stadiju apzīmējošajam skaitlim pievieno burtu “B”, savukārt “A” aiz stadiju apzīmējošā skaitļa pievieno tad, ja šādu simptomu pacientam nav.
Hodžkina limfomai ir šādas stadijas:

Slimības prognoze ir sliktāka E stadiju un/vai B simptomu gadījumā, kā arī lielas audzēja slodzes vai paaugstināta eritrocītu grimšanas ātruma. Pacientiem ar šiem riska faktoriem nepieciešama intensīvāka ārstēšana nekā pacientiem, kuriem to nav.
Svarīgs faktors, diagnosticējot Hodžkina limfomu, ir audzēja apmērs (bulky disease). Parasti audzēju par lielu uzskata tad, ja tas pārsniedz 10 cm diametrā vai – ja tas atrodas krūškurvī – aizņem vismaz trešo daļu no krūšu platuma. Liela apmēra audzējam parasti ir nepieciešama intensīvāka ārstēšana.

Ar dzīvildzi apzīmē to cilvēku īpatsvaru, kas ir dzīvi noteiktu laika periodu pēc diagnozes noteikšanas, un tā ir atkarīga no dažādiem faktoriem, piemēram, no pacienta vecuma, kopējā veselības stāvokļa, B simptomu klātbūtnes, kā arī no tā, cik laicīgi slimība diagnosticēta.

Mūsdienās Hodžkina limfomas dzīvildzes rādītāji ir augsti, it sevišķi tiem cilvēkiem, kam slimība atklāta agrīni. I stadijas Hodžkina limfomai 5 gadu dzīvildze ir ap 95%, II stadijas gadījumā dzīvildzes rādītājs ir ap 90%, III stadijai tas pārsniedz 85%, bet IV stadijai ir nedaudz zem 85%.
Vienlaikus jāpiezīmē, ka dzīvildzes statistika ir vispārīgi rādītāji, kas balstās datos par daudziem tūkstošiem cilvēku ar konkrēto diagnozi – tie sniedz tikai vispārīgu priekšstatu par dzīvi ar šo vēzi, taču nepasaka, kāda dzīvildze būs konkrētajam pacientiem. Piemēram, ja cilvēkam nav citu saslimšanu un kopējais veselības stāvoklis ir labs, paredzamais mūža garums var būt lielāks nekā vidējais statistiskais rādītājs. Turklāt jāņem vērā, ka dzīvildzes statistikā tiek iekļauti cilvēki, kuru diagnoze noteikta ne mazāk kā pirms pieciem gadiem, tātad paši jaunākie medicīnas sasniegumi un jaunas ārstēšanas iespējas šie dati neatspoguļo.

Ārstēšanas taktikas izvēle ir atkarīga no Hodžkina limfomas stadijas un izplatības, kā arī no kopējā veselības stāvokļa un pacienta vecuma. Katrs gadījums tiek apspriests multidisciplinārā ārstu konsīlijā, kurā piedalās ķirurgs, radiologs, onkologs ķīmijterapeits, staru terapeits, ģenētiķis, patologs; nepieciešamības gadījumā var tikt piesaistīti citi speciālisti.

Konsīlija laikā, izvērtējot pacienta izmeklējumus, vispārējo stāvokli un blakusslimības, tiek sastādīts individuāls ārstēšanas plāns. Katra pacienta ārstēšanas un izmeklēšanas laikā šādas sanāksmes var būt arī vairākas.
Visbiežāk Hodžkina limfomas ārstēšanai izmanto ķīmijterapiju, retāk staru terapiju vai šo abu metožu kombināciju; rezistences gadījumos bieži piemērota ir arī mērķterapija, imūnterapija un asinsrades cilmes šūnu transplantācija.
Ķīmijterapija ir vēža ārstēšana ar medikamentiem, kas iznīcina vēža šūnas, apturot to augšanu vai vairošanos. Ķīmijterapijas laikā tiek bojātas arī veselās šūnas, īpaši tās, kas ātri dalās (kaulu smadzeņu šūnas, gremošanas trakta epitēlijšūnas, dzimumšūnas, šūnas matu saknēs un tml.), tomēr šīs šūnas pēc ķīmijterapijas parasti atjaunojas.
Dažas no biežāk lietotajām ķīmijterapijas medikamentu kombinācijām jeb shēmām Hodžkina limfomas ārstēšanai ir šādas:
Atsevišķi ķīmijterapijas medikamenti ir tablešu formā, tomēr Hodžkina limfomas gadījumā ķīmijmedikamentus visbiežāk ievada vēnā. Lai atvieglotu ķīmijmedikamentu ievadīšanu, izmanto dažādu veidu katetrus:
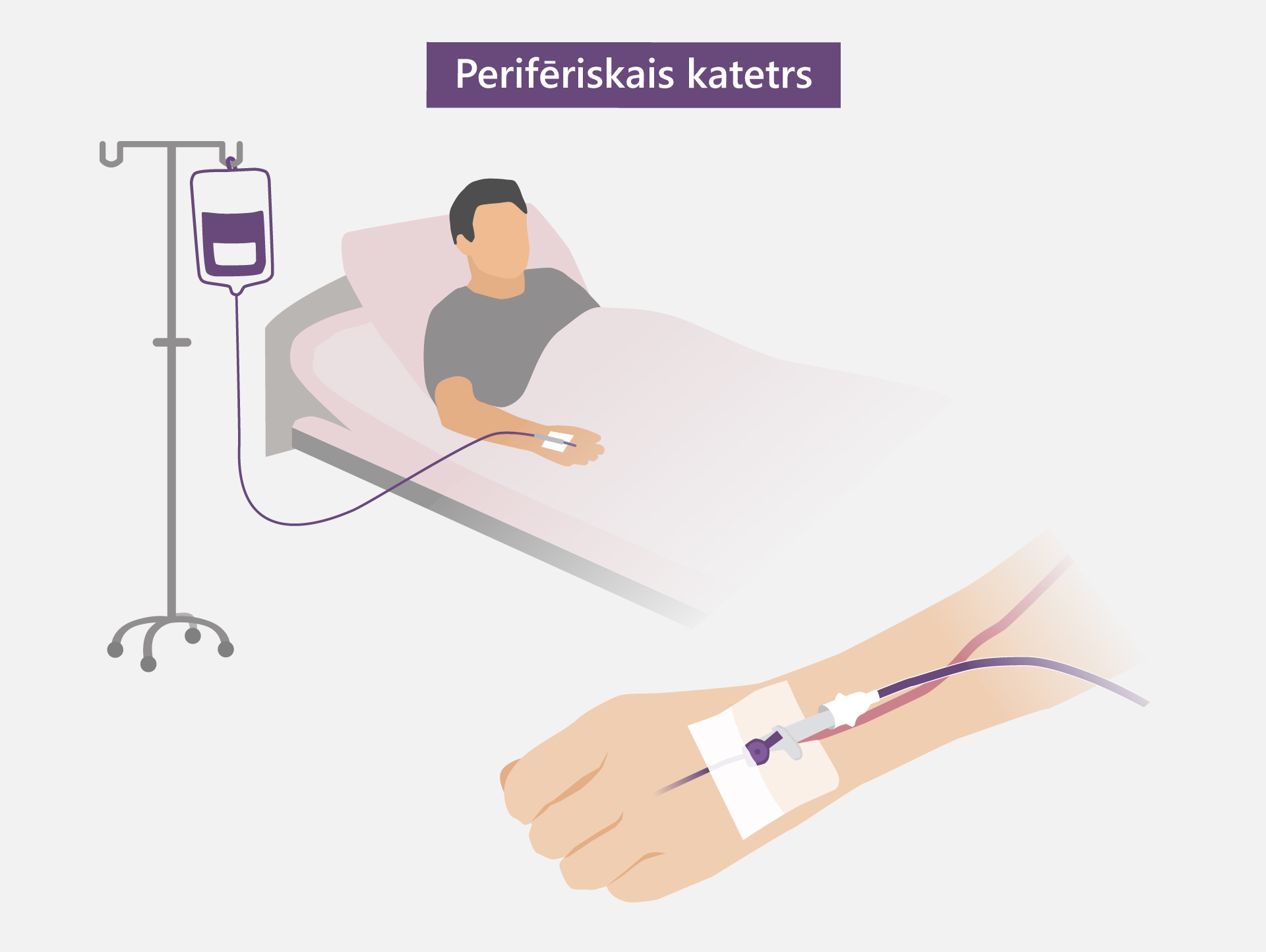
⦁ Perifēro vēnas katetru izmanto, ja nepieciešama īslaicīga intravenoza terapija ar pieeju vēnai līdz 72 stundām. Pēc tam ievadītais katetrs tiek izņemts un nepieciešamības gadījumā citā vietā tiek ievietots jauns katetrs. Katetra maiņa var būt nepieciešama arī ātrāk, ja rodas iekaisuma pazīmes (apsārtums, sāpīgums, nieze, pietūkums), katetrs nedarbojas, ir aizsprostots.
⦁ Centrālo venozo katetru (CVK) izmanto, ja nepieciešama ilgstoša intravenoza terapija, ja lieto perifērās vēnas kairinošus medikamentus vai ja piekļūšana tām ir apgrūtināta. Tāpat kā perifērais katetrs, CVK nodrošina medikamentu ievadi jebkurā diennakts laikā. Centrālais venozais katetrs var būt ar vairākām pieejām vēnai (2-6 zari), kas redzamas ārpusē virs ādas. Katetram marles pārsēju maina pēc katras medikamentu ievadīšanas vai tad, ja tas ir kļuvis mitrs un netīrs. Katetra pieejas (zari) ir jāskalo katru dienu, tādējādi pasargājot tās no asins recekļu veidošanās. Katetru parasti lieto ne ilgāk par mēnesi. Jāziņo māsai vai ārstam, ja katetrs rada diskomforta sajūtu – sāpīgumu vai spīlējošu sajūtu katetra vai medikamenta ievades vietā, kā arī tad, ja 30–60 minūtes pēc medikamenta ievades ķermeņa temperatūra pieaug līdz 38 °C vai vairāk.
⦁ Porta katetru izmanto, ja nepieciešama ilgstoša ķīmijpreparātu ievade vai ja tie vienas diennakts laikā jāievada atkārtoti, ja bieži tiek ņemti asins paraugi, kā arī, ja jāpārlej asins preparāti. Porta katetrs ir plāna, elastīga caurulīte, kura ar vienu galu tiek ievietota kādā no centrālajām vēnām (biežāk krūškurvja labajā augšējā daļā), savukārt otrs gals tiek nevis izvadīts ārpusē, bet noslēdzas krātuvē jeb portā, kas atrodas zemādā. Intravenozais porta katetrs sastāv no silikona vai poliuretāna caurulītes un titāna kameras. Kameras ievietošanu zemādā atvieglo speciāli veidots apvalks. Kameras centrālo daļu veido silikona membrāna vai starpsiena, caur kuru tiek veiktas injekcijas ar speciālu adatu, kas nebojā membrānu un neļauj veidoties sūcei. Porta katetru implantē lokālā anestēzijā, un tā ir ķirurģiska manipulācija, kura notiek operāciju zālē.

Zemādas intravenozais porta katetrs ir ierīce, kuru ievada zemādā, un tas var palikt asinsvadā pat līdz pieciem gadiem. Tā iespējams izvairīties no diskomforta un atkārtotām injekcijām – pirms katras medikamentu ievadīšanas nav jāpunktē vēna. Katetrs nemaina slimnieka ierasto dzīves veidu un neierobežo aktivitātes. Katetra ievades vieta nav sāpīga, to nevar pamanīt, uz ādas paliek tikai nelielas rētas, kuras ar laiku izbalē. Katetrs neierobežo kustības pat medikamenta ievadīšanas laikā; tas netraucē arī personīgajā higiēnā, vienīgi gadījumā, kad katetrā ir ievadīta adata, jāizvairās to samitrināt.
Ievadot medikamentus, eritrocītu masu vai ņemot asins paraugu, katetra kamerā paliek mikrodaļiņas, kas var to aizsprostot, kā arī pakļaut pacientu infekcijas riskam. Tāpēc pēc visām manipulācijām ar porta katetru tas ir jāizskalo un tajā jāievada heparīna šķīdums. Heparīns nogulsnējas uz katetra sieniņām un novērš asins recekļu veidošanos tajā.
Ja porta katetrs netiek lietots, skalošana un apstrāde ar heparīna šķīdumu jāveic reizi mēnesī. Infekcijas simptomi implantētā katetra rajonā var parādīties arī pēc izrakstīšanās no slimnīcas. Tādēļ svarīgi atpazīt simptomus, kas liecina par katetra infekciju: ādas apsārtumu, karstumu, sāpes katetra rajonā vai arī paaugstinātu ķermeņa temperatūru virs 38 °C, drudzi, drebuļus. Parādoties pazīmēm, nekavējoties jāvēršas pie ārsta.
Ķīmijterapijas medikamenti iedarbojas ne tikai uz vēža šūnām, bet arī uz veselajām šūnām – pārsvarā tādām, kurām raksturīga aktīva dalīšanās: tās ir kaulu smadzeņu šūnas, gremošanas trakta epitēlijšūnas, dzimumšūnas, šūnas matu saknēs un tml. Blakusparādības attīstās ļoti individuāli un neskar visus vienādi: to skaits un smaguma pakāpe atkarīga gan no pacienta veselības stāvokļa, gan no medikamenta veida un devas. Vairums ķīmijterapijas blakņu ir īslaicīgas un labi kontrolējamas ar medikamentiem vai dzīvesveida korekciju. Bieži ķīmijterapija izraisa noteikta veida asinsķermenīšu skaita samazināšanos:
Vairums pacientu jūtas noguruši, samazinās apetīte, izraisot svara zudumu, var būt slikta dūša vai vemšana, iespējama caureja. Citas izplatītas ķīmijterapijas blakusparādības ir šādas:
Vairāk par ķīmijterapijas norisi un blaknēm iespējams uzzināt Rīgas Austrumu klīniskās universitātes slimnīcas Latvijas Onkoloģijas centra tīmekļa vietnes sadaļā «Bukleti onkoloģijas pacientiem«, e-brošūrā «Ķīmijterapija», kā arī Latvijas Onkologu ķīmijterapeitu asociācijas veidotajos video materiālos: «Ķīmijterapijas ABC. Kas jāzina pacientam» un «Ķīmijterapijas blaknes. Kas jāzina, lai justos labāk». Plašāk par ķīmijterapijas blakusparādībām iespējams lasīt: ŠEIT
Staru terapija ir augstas enerģijas starojuma (rentgena stari, gamma stari, neitroni, protoni un citi) izmantošana vēža šūnu iznīcināšanai un audzēju samazināšanai. Ārstējot Hodžkina limfomu, staru terapiju visbiežāk izmanto kopā ar ķīmijterapiju.
Visbiežāk izmanto ārējo jeb distances staru terapiju, kad starojums tiek raidīts no iekārtas ārpus ķermeņa. Šī procedūra ir īsa un nesāpīga. Pirms staru terapijas uzsākšanas pacientam tiek veikta ārstēšanas kursa plānošana: veikts datortomogrāfijas vai rentgena izmeklējums un uz pacienta ādas veiktas speciālas atzīmes, kas pirms katra staru terapijas seansa palīdz precīzi pozicionēt apstarojamās ķermeņa vietas. Var tikt izgatavota arī speciāla veidne vai maska, kas palīdz augumu noturēt nekustīgā stāvoklī. Plānošanas sesija var ilgt līdz 2 stundām. Staru terapijas seansi parasti notiek 5 reizes nedēļā, un viss ārstēšanas kurss var ilgt no dažām dienām līdz vairākām nedēļām.
Pasaulē izmanto arī tādu staru terapijas metodi kā protonu terapiju, kas dažiem audzēju veidiem var būt vispiemērotākā, turklāt rada mazāk bojājumu audos ap audzēju, taču protonu terapiju Latvijā pagaidām nepraktizē.
Staru terapija ir lokāla ārstēšanas metode, tādēļ blakusparādības parasti ir saistītas ar apstaroto ķermeņa zonu – vēdera ādu un orgāniem tiešā kuņģa tuvumā. Staru terapijas laikā un pēc tās visbiežāk novērojams nogurums, caureja, gremošanas traucējumi, nelaba dūša, ādas kairinājums; lielākā daļa blakusefektu attīstās pamazām, ārstēšanās laikā kļūst spēcīgākas un pakāpeniski pāriet pēc staru terapijas beigām.
Vairāk par staru terapijas norisi iespējams uzzināt Rīgas Austrumu klīniskās universitātes slimnīcas Latvijas Onkoloģijas centra tīmekļa vietnes sadaļā «Bukleti onkoloģijas pacientiem», e-brošūrā «Distances staru terapija», kā arī video materiālā «Onkoloģijas pacienta ABC. Staru terapija».
Imūnterapija palīdz stiprināt vai atjaunot imūnsistēmas spēju cīnīties ar vēzi, iznīcināt audzēja šūnas un apturēt to augšanu un izplatīšanos.
Hodžkina limfomas ārstēšanai parasti lieto imūnsistēmas kontrolpunktu inhibitoru terapiju. Svarīga imūnsistēmas funkcija ir tās spēja neuzbrukt normālām organisma šūnām. Tas iespējams, pateicoties "kontrolpunktiem" – olbaltumvielām uz imūnšūnām, kuras tiek aktivizētas, lai sāktos imūnā reakcija. Vēža šūnas izmanto šos kontrolpunktus, lai izvairītos no imūnsistēmas uzbrukuma. Medikamentus, kas iedarbojas uz šiem kontrolpunktiem, sauc par imūnsistēmas kontrolpunktu inhibitoriem, un tie ļauj imūnsistēmas šūnai “pamanīt” vēža šūnu un to iznīcināt. Ir vairākas kontrolpunktu inhibitoru grupas:
Imūnsistēmas kontrolpunktu inhibitoru terapija blakusparādības izraisa tādēļ, ka imūnsistēma uzbrūk ķermeņa veselajām šūnām. Blakņu smaguma pakāpe variē no vieglām līdz dzīvībai bīstamām, kā arī dažādiem imūnterapijas medikamentiem atšķiras, taču vairums blakņu ir labi kontrolējamas, ja tiek laicīgi konstatētas. Smagākas blakusparādības parasti ir tad, ja tiek kombinēti vairāki imūnsistēmas kontrolpunktu inhibitori. Ļoti smagu blakusparādību gadījumā imūnterapija ar konkrēto medikamentu ir jāpārtrauc. Blaknes visbiežāk ietekmē šo ķermeņa daļu darbību:
Retāk sastopami nervu sistēmas, nieru, redzes, aizkuņģa dziedzera un sirds darbības traucējumi.

Daudzas (bet ne visas) no minētajām blakusparādībām risina ar kortikosteroīdu palīdzību – tie ir medikamenti, kas samazina imūnsistēmas aktivitāti (šī iemesla dēļ kortikosteroīdi nepalīdz hormonālajiem traucējumiem). Visbiežāk lieto prednizonu un metilprednizolonu. Taču arī steroīdu terapijai var būt savas blaknes, piemēram, palielināta apetīte un svara pieaugums, garastāvokļa svārstības, ūdens aizture organismā, augsts asinsspiediens. Ilgstoša kortikosteroīdu lietošana veicina osteoporozi un padara organismu uzņēmīgāku pret infekcijām. Svarīgi atcerēties, ka steroīdus nedrīkst pārtraukt lietot pēkšņi – deva ir jāsamazina pakāpeniski, vairāku nedēļu garumā.
Cilmes šūnu transplantācija ir viens no Hodžkina limfomas ārstēšanas veidiem. Tā ir sarežģīta ārstēšanas metode ar iespējamām komplikācijām, tādēļ to nozīmē tikai tad, kad ar ķīmijterapiju vien labus ārstēšanas rezultātus nevar sasniegt, t.i. nevar iznīcināt visas audzēja šūnas. Nepieciešamība pēc asinsrades cilmes šūnu transplantācijas var rasties gadījumā, kad Hodžkina limfoma ir IV stadijā vai tai ir augstas malignitātes pakāpe.
Transplantācijas princips Hodžkina limfomas gadījumā ir šāds: ar lielām ķīmijterapijas devām iznīcina audzēju, taču vienlaikus tiek iznīcinātas par asinsradi atbildīgās kaulu smadzenes un tās vairs nespēj ražot normālas asins šūnas. Lai cilvēks neaizietu bojā asins šūnu trūkuma dēļ, viņam transplantē cilmes šūnas, kas atjauno normālu kaulu smadzeņu darbību un asins sastāvu.
Asinsrades cilmes šūnas ir šūnas, no kurām veidojas visas asins šūnas, un tas galvenokārt notiek kaulu smadzenēs. Kaulu smadzenes atrodas kaulu iekšpusē, tās tiek sauktas arī par sarkanajām kaula smadzenēm. Visvairāk to ir krūšu kaulā, iegurņa kaulos, ribās, galvaskausā, mugurkaula skriemeļos.

Asinsrades cilmes šūna atkarībā no vajadzības attīstās divos dažādos virzienos:
• kā mieloīdā šūna, ja nepieciešami eritrocīti, trombocīti, granulocīti vai monocīti;
• kā limfoīdā šūna, ja nepieciešams izveidot limfocītus.
Transplantācijas vajadzībām cilmes šūnas Hodžkina limfomas gadījumā parasti savāc no perifērajām asinīm – tās ir asinis, kas atrodas asinsvados tajās organisma daļās, kur var paņemt asinis analīzei, piemēram, rokas vēnā. Šajās asinīs ir dažādi asins šūnu veidi, tostarp arī ļoti neliels daudzums cilmes šūnu, kuru veidošanās tiek stimulēta ar speciālu medikamentu palīdzību, lai izveidotos pietiekams daudzums transplantācijai.
Perifēro asinsrades cilmes šūnu transplantācija var būt divu veidu: autologā – ja transplantējamās cilmes šūnas tiek ņemtas no paša slimnieka, un alogēnā – ja šūnas tiek ņemtas no kāda cita – donora – asinīm. Pašlaik ir zinātniski pierādīts, kuru hematoloģisko slimību gadījumā labāk izdarīt autologo un kuru – alogēno transplantāciju. Limfomas gadījumā visbiežāk lieto autologo cilmes šūnu transplantāciju.
Autologās cilmes šūnu transplantācijas būtība ir šāda: pirms transplantācijas cilmes šūnas tiek savāktas un sasaldētas. Slimniekam tiek nozīmēta ķīmijterapija ar lielākām medikamentu devām nekā parasti, t.s. augstu devu ķīmijterapija. Tās rezultātā tiek nogalinātas visas audzēja šūnas organismā, taču vienlaikus iet bojā arī normālo kaulu smadzeņu šūnas. Lai nerastos lielas komplikācijas un dzīvībai bīstams stāvoklis, bojāto kaulu smadzeņu un līdz ar to arī mainīto asins šūnu sastāva dēļ slimniekam tiek transplantētas iepriekš savāktās cilmes šūnas. Tās ievada caur centrālo vai porta katetru. Kaula smadzeņu un asins šūnas pilnībā atjaunojas aptuveni 1–3 mēnešu laikā pēc transplantācijas.
Alogēnā transplantācija ir sarežģītāka, jo šūnas, kuras transplantē, tiek ievāktas nevis no pacienta, bet no donora. Šūnu savākšana, sasaldēšana un glabāšana neatšķiras no autologās transplantācijas, taču slimniekam ārstēšana ir sarežģītāka: lai nenotiktu donora šūnu atgrūšana, papildu jālieto imunitāti nomācoši medikamenti. Limfomas gadījumā alogēno transplantāciju nozīmē samērā reti.
Autologajai perifēro asinsrades cilmes šūnu transplantācijai cilmes šūnas tiek iegūtas no pacienta. Katra cilvēka perifērajās asinīs var atrast ļoti, ļoti nelielu skaitu cilmes šūnu, bet ar tām transplantācijai nepietiek. Tādēļ slimniekam tiek nozīmēti īpaši medikamenti, kurus sauc par koloniju stimulējošiem faktoriem un kas iedarbojas uz kaulu smadzenēm, pastiprinot cilmes šūnu veidošanos un palielinot to daudzumu asinīs.
Pirms cilmes šūnu savākšanas tiek paņemts slimnieka asins paraugs, lai noteiktu, cik daudz cilmes šūnu ir asinīs. Ja to daudzums ir pietiekams, tad sāk šūnu savākšanu – speciāla aparatūra izfiltrē tās no asinīm. Lai to izdarītu, slimnieka vēnās tiek ievadīti divi katetri – pa vienu asinis caur sistēmas vadiem nonāk aparātā, pa otru asinis, no kurām ir atdalītas cilmes šūnas, plūst atpakaļ. Procedūra ilgst aptuveni 3–4 stundas. Citas normālās asins šūnas netiek bojātas. Lai savāktu pietiekamu skaitu šūnu transplantācijai, procedūru parasti atkārto 3–4 dienas pēc kārtas. Pēc tam slimnieks tiek izrakstīts no slimnīcas.
Cilmes šūnas pēc savākšanas tiek apstrādātas ar īpašiem preparātiem, lai tās varētu sasaldēt. Tās tiek uzglabātas šķidrajā slāpeklī –180 °C temperatūrā. Sasaldēšana un glabāšana notiek speciālā iekārtā, šķidrā slāpekļa daudzums un temperatūra tiek nemitīgi kontrolēta, lai uzturētu nemainīgu glabāšanas režīmu. Sasaldētas šūnas savu dzīvotspēju saglabā pat vairākus gadu desmitus.
Transplantācijas dienā šūnas tiek izņemtas no šķidrā slāpekļa, speciālā aparatūrā atlaidinātas un pilienu veidā pa asinsvadā ievietotu katetru intravenozi ievadītas slimniekam – tā tad arī ir transplantācija. Šūnu ievadīšanas procedūra ir nesāpīga, transplantācijas laikā slimnieks atrodas guļus un var brīvi sarunāties ar medicīnas personālu, kas tobrīd veic transplantāciju un novēro pacientu. Transplantētās cilmes šūnas ar asins plūsmu ceļo uz kaulu smadzenēm, kur tās sāk augt un vairoties. Slimniekam katru dienu tiek kontrolēta asins analīze, lai novērtētu kaulu smadzeņu atjaunošanās procesu.
Lai cilmes šūnas sāktu augt un atjaunotos normāla kaulu smadzeņu darbība un asins sastāvs, ir vajadzīgs laiks. Pēc transplantācijas pacients atrodas vienvietīgā izolētā palātā, kur tiek nodrošināti īpaši, sterili apstākļi. Tā kā asinīs normālo šūnu skaits ir ļoti mazs, slimniekam profilaktiski jālieto antibiotikas un pretsēnīšu medikamenti. Ja nepieciešams, pacientam pārlej eritrocītu masu vai trombocītu masu.
Pēc transplantācijas mazā leikocītu skaita dēļ ir arī ēšanas ierobežojumi, nedrīkst ēst, piemēram, augļus, svaigus dārzeņus, piparus, taču par to pacientu informē atsevišķi. Slimnieku apmeklēt var tikai veseli ģimenes locekļi un draugi, ja kādam ir infekcija – no apmeklējuma jāatturas. Kad asins sastāvs atjaunojas līdz normālam līmenim, slimnieku izraksta.
Cilmes šūnu donors var būt cilvēks, kas ir saderīgs ar slimnieku. Saderību nosaka, ka gan uz slimnieka, gan donora šūnām ir vienādi šūnu receptori – HLA sistēmas antigēni (no angļu val. – human leukocyte antigen, cilvēka leikocītu antigēni). Visaugstākā saderības iespēja ir brāļiem un māsām, tādēļ viņus kā potenciālos donorus izmeklē vispirms. Gan pacientam, gan radiniekam paņem asinis no vēnas un nosūta uz īpašu laboratoriju Valsts asins donoru centrā. Citi attālāki radinieki parasti par donoriem neder. Ja ģimenē saderīga donora nav, tad tas jāmeklē ārpus ģimenes īpašos donoru reģistros.
Cilmes šūnu transplantācijas laikā iespējamas blakusparādības, kuras izraisa galvenokārt transplantācijas procesā izmantotā augstas devas ķīmijterapija. Izplatītākās blakusparādības ir šādas:
Pēc cilmes šūnu transplantācijas iespējama arī paliekoša neauglība, sievietēm arī agrīna menopauzes iestāšanās. Cilvēki, kas vēlas saglabāt pēcnācēju radīšanas iespēju, var apsvērt olšūnu vai spermas sasaldēšanu. Šis jautājums jau laikus jāapspriež ar ārstējošo ārstu.
Mērķterapija izmanto zāles, kas mērķtiecīgi iedarbojas uz konkrētām molekulām (piemēram, olbaltumvielām) uz vēža šūnām vai to iekšienē. Tā kā šīs molekulas palīdz sūtīt signālus, kas liek šūnām augt vai dalīties, tad, mērķtiecīgi uz šīm molekulām iedarbojoties, iespējams apturēt vēža šūnu augšanu un izplatīšanos.
Hodžkina limfomas ārstēšanā visbiežāk izmantotais medikaments ir monoklonālā antiviela rituksimabs, un to parasti lieto kopā ar ķīmijpreparātiem vai reizē ar staru terapiju. Rituksimabs var izraisīt alerģiskas reakcijas, tādēļ pirms katras devas ievadīšanas pacientam jālieto arī medikamenti alerģisku reakciju mazināšanai. Pirmo reizi ievadot šo medikamentu, to dara ar infūzijas palīdzību – ja pacients medikamentu panes labi, nākamās devas var ievadīt ar zemādas injekciju, šādi procedūru padarot ātrāku.
Tas, kādas un cik izteiktas blakusparādības būs, lietojot mērķterapijas medikamentus, atkarīgs no dažādiem faktoriem, tostarp pacienta vispārējā veselības stāvokļa, no tā, vai tiek lietotas vienas zāles vai vairākas, kā arī no medikamenta devas.
Rituksimabs var veicināt iepriekš iegūtas B hepatīta infekcijas saasināšanos. Tā ir nopietna blakne, kas rada aknu bojājumus un var būt dzīvībai bīstama, tādēļ pirms rituksimaba terapijas uzsākšanas parasti tiek veikts hepatīta tests.
Ķirurģisku ārstēšanu Hodžkina limfomas gadījumā parasti nepielieto.
Būtiska vēža ārstēšanas sastāvdaļa ir rehabilitācija. Tās mērķis ir sekmēt, lai cilvēks vēža ārstēšanas laikā un pēc tās varētu atgriezties ierastajā dzīvē un veikt ikdienas aktivitātes. Rehabilitācijas pakalpojumus sniedz multidiscpilināra speciālistu komanda, kurā parasti ietilpst psihologs, fizioterapeits, ergoterapeits, uztura speciālists, onkoloģiskās aprūpes māsa, arī mākslas vai mūzikas terapeits un sociālais darbinieks.
Fizioterapija palīdz mazināt sāpes, stīvumu, nejutīgumu, kustību ierobežojumus vai citas fiziskās problēmas, kas radušās vēža ārstēšanas rezultātā, savukārt ergoterapija palīdz atgūt spēju veikt ikdienas uzdevumus, sākot ar ģērbšanos vai ēst gatavošanu un beidzot ar atgriešanos darbā. Ar vēža ārstēšanu saistītā noguruma, trauksmes, stresa, depresijas, bezpalīdzības pārvarēšanā atbalstu sniedz psihologs. Rehabilitācijas plāns tiek piemērots katram pacientam individuāli, atkarībā no funkcionēšanas traucējumu pakāpes. Vieglu vai mērenu funkcionēšanas grūtību gadījumā rehabilitācija parasti notiek ambulatori, smagāku funkcionēšanas traucējumu gadījumā rehabilitāciju nodrošina stacionārā. Lasīt vairāk>>
Tas, kā noritēs tālākā onkoloģiskā uzraudzība pēc ārstēšanas beigām, atkarīgs no Hodžkina limfomas paveida, stadijas, kurā tā tikusi atklāta, saņemtā terapijas veida un citiem faktoriem. Parasti pirmo gadu vai divus būs nepieciešams apmeklēt ārstu ik pēc 3–6 mēnešiem, tāpat arī jāveic regulāras asinsanalīzes. Ja nepieciešams, ārsts nozīmēs arī datortomogrāfijas vai PET (pozitronu emisijas tomigrāfijas) izmeklējumus. Ar laiku ārsta vizītes kļūs retākas – reizi vai divas gadā. Taču ir svarīgi griezties pie speciālista, ja parādās nebijuši simptomi vai rodas ar veselības stāvokli saistītas sūdzības, jo tās var liecināt par slimības atgriešanos.
Dažas Hodžkina limfomas terapijas blakusparādības var attīstīties ilgi pēc ārstēšanas beigām. Nopietnākās no tām ir citi ļaundabīgi audzēji (cilvēkiem, kas pārcietuši Hodžkina limfomu, ir paaugstināts krūts, plaušu vēža un melanomas risks), sirds veselības problēmas, hipotireoze jeb pavājināta vairogdziedzera funkcija, samazināta auglība vai neauglība. Tādēļ jāveic regulāri vēža skrīninga un citi profilaktiskie izmeklējumi, kā arī jāseko pārējām uzraugošā ārsta norādēm.

Liela daļa no zināmajiem Hodžkina limfomas riska faktoriem nav ietekmējami, tādēļ pagaidām nav zināmu veidu, kā to profilaktiski novērst. Taču ir iespējams nedaudz samazināt iespēju ar to saslimt, izvairoties no noteiktām infekcijas slimībām un uzturot veselīgu imūnsistēmu.

